77.2%患者达到客观缓解,齐鲁组合抗体新药QL1706治疗宫颈癌II期结果公布
2022年11月5日–12日,"中国临床肿瘤学会(CSCO)年会学术周"在北京、上海、广州、哈尔滨和济南五个城市举行。会上,齐鲁制药以壁报形式公布了其在研新型组合抗体QL1706 II期研究的最新结果。该研究旨在评估QL1706联合紫杉醇-顺铂/卡铂加或不加贝伐珠单抗一线治疗复发或转移性宫颈癌的安全性和有效性。研究由辽宁省肿瘤医院王丹波院长和山东省肿瘤医院刘乃富主任牵头,于国内13家临床研究中心开展。数据显示,未接受过系统治疗的复发或转移性宫颈癌患者接受QL1706联合化疗加或不加贝伐珠单抗,客观缓解率(objective response rate, ORR)为77.2%。

在全世界范围内,宫颈癌的发病率及死亡率在女性中位居前列。超过一半的患者在确诊时已经发生疾病进展而失去根治性手术的机会,需要接受系统性抗肿瘤治疗。QL1706是齐鲁制药MabPair技术平台研发的同时靶向程序性死亡受体1(PD-1)和细胞毒性T淋巴细胞相关蛋白4(CTLA-4)的双免疫检查点的新型治疗用组合抗体。前期临床研究结果显示,QL1706单药治疗复发/转移性宫颈癌初步显示出良好的疗效和安全性。
此次报告的研究为一项开放、非随机、多中心II期研究。研究对象为既往未接受过系统性治疗的复发或转移性宫颈癌患者。共有60例患者参加研究并接受了治疗,分为2个队列:QL1706联合化疗与QL1706联合化疗+贝伐珠单抗。每3周给药1次。完成6个周期的化疗后,可以停止化疗继续接受QL1706加或不加贝伐珠单抗治疗,直至疾病进展或毒性不能耐受等。
研究结果表明,QL1706联合化疗加或不加贝伐珠单抗一线治疗复发或转移性宫颈癌安全性可控且符合预期。最常见的不良反应为白细胞计数降低(48.3%),其次为贫血(33.3%)。严重不良反应的发生率为20%。免疫相关不良反应的发生率为23.3%。
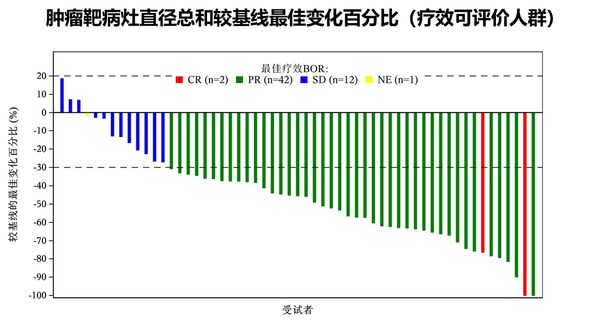
QL1706联合化疗加或不加贝伐珠单抗一线治疗复发或转移性宫颈癌显示出优秀的抗肿瘤活性。共有57例患者纳入疗效分析,ORR为77.2%,疾病控制率为98.2%。至数据截止时,中位无进展生存期(PFS)和总生存期(OS)数据尚未成熟。目前,基于这项研究结果,已开展一项旨在评价QL1706联合紫杉醇-顺铂/卡铂加或不加贝伐珠单抗一线治疗复发或转移性宫颈癌的有效性和安全性的Ⅲ期临床研究。
更多精彩:
2022年ASCO年会上QL1706相关研究报告刊登于美国临床肿瘤学会《Journal of Clinical Oncology》期刊
https://ascopubs.org/doi/abs/10.1200/JCO.2022.40.16_suppl.5535